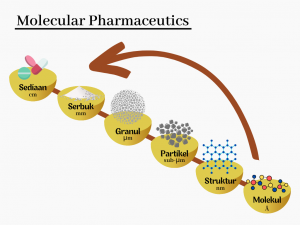
Tema penelitian kami berfokus kepada pengembangan dan karakterisasi formulasi sediaan obat dan kosmetik dengan meningkatkan kelarutan zat aktif farmasi yang tidak atau kurang larut dalam air berdasarkan konsep “molecular Pharmaceutics” (Gambar 1). Slogan tim riset kami adalah “we wanna improve the solubility”
Tujuan penelitian kami adalah mendapatkan formula obat dan kosmetik yang sangat efektif dan aman sehingga bisa dijadikan sebagai pedoman untuk desain formulasi obat dan kosmetik yang lebih baik yang dapat menggambarkan hubungan antara bahan farmasi aktif dan eksipien dalam skala molekul pada formula sediaan dengan sifat farmasetikanya seperti profil disolusi dan stabilitas sediaan (Gambar 2). Kami telah mempreparasi dan mengkarakterisasi berbagai formula sediaan farmasi dengan meningkatkan kelarutan bahan aktif yang tidak atau kurang larut dalam air, seperti amorf dispersi padat (amorphous solid dispersion), kokristal, koamorf (coamorphous), dan penggunaan bahan pembawa berpori seperti silika mesopori. Berdasarkan evaluasi keadaan molekuler dari bahan farmasi aktif dan eksipien dalam formula, penelitian kami dapat memaksimalkan efek dari bahan aktif farmasi pada inovasi formula sediaan farmasi khusus tersebut. Selain itu, baru-baru ini juga kami mencoba memperluas aspek penelitian kami dengan mengelusidasi karakterisasi keadaan molekuler dari bahan farmasi aktif dan eksipien dalam formula, dan hubungannya dengan sifat farmakinetikanya Gambar 2).
Berikut ini adalah beberapa proyek penelitian utama yang sedang kami kerjakan.
- Optimasi preparasi formulasi berdasarkan karakterisasi bahan aktif farmasi
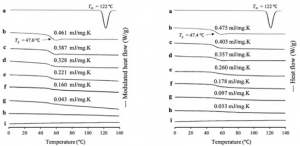
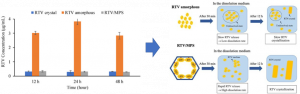
Optimasi preparasi dalam suatu formulasi merupakan parameter penting untuk mendapatkan formula yang optimal, bahkan karakterisasi dalam skala molekul dari bahan aktif farmasi dan eksipien dalam formulasi sediaan padat bisa dijadikan landasan untuk mendapatkan metode preparasi yang paling efisien dalam formula tersebut. Pada penelitian kami sebelumnya, kami menggunakan DSC, PXRD dan FT-IR untuk menentukan jumlah maksimal dari zat aktif yang dapat dimasukkan ke dalam silika mesopori sebagai pembawa. Kami berhasil menganalisa jumlah maksimal obat yang dimasukkan kedalam silika mesopori dari nilai delta CP dan nilai Heat of fusion dari pengukuran menggunakan DSC (Gambar 3). Kami juga berhasil mengevaluasi amorfisasi dari obat tersebut menggunakan PXRD, serta mengelusidasi interaksi antara obat dengan silika mesopori menggunakan FT-IR.
Gambar 3. (Left) DSC curve and (right) DSC curve of (a) RTV crystal, (b) (left) RTV EVPs, (right) RTV Ms, RTV/MPS1 = (c) 8:2, (d) 7:3, (e) 6:4, (f) 5:5, (g) 4:6, (h) 3:7 and (i) MPS1. (Left) RTV/MPS1 prepared by solvent evaporation and (right) melt method (Budiman, Arif, and Diah Lia Aulifa. Pharmaceuticals 15.1 (2022): 93).
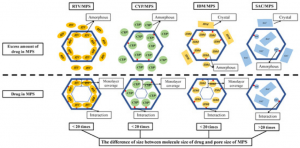
Gambar 4. Schematic illustration of RTV/MPS, CYP/MPS, IDM/MPS and SAC/MPS (Budiman, Arif, and Diah Lia Aulifa. Pharmaceuticals 15.1 (2022): 93).
- Elusidasi bahan aktif farmasi dan eksipien dalam skala molekul dalam formula
Studi mekanisme interaksi molekul bahan aktif farmasi dan eksipien dalam skala molekul dalam suatu formulasi merupakan faktor penting terutama untuk menjelaskan pengaruh penambahan eksipien terhadap sifat farmasetika termasuk disolusi dan stabilitas dari bahan aktif farmasi tersebut. Studi mekanisme ini bisa menjadi pedoman untuk desain formulasi obat dan kosmetik yang lebih baik yang dapat menggambarkan hubungan antara bahan farmasi aktif dan eksipien dalam skala molekul pada formula sediaan sehingga dihasilkan formula obat dan kosmetik yang sangat efektif dan aman. Pada penelitian kami sebelumnya, kami berhasil mengklarifikasi interaksi antara obat dengan koformer dalam silika mesopori dalam skala molekul seperti terlihat pada gambar 3. Kami juga berhasil menggambarkan hubungan interaksi obat dan kofomer dalam skala molekul yang dienkapsulasi ke dalam silika mesopori dengan profil disolusi dari obat tersebut, seperti yang terlihat pada gambar 4.
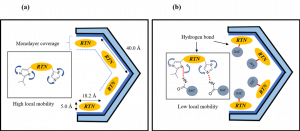
Gambar 5. Schematic illustration of (a) RTN amorphous/TMPS, and (b) RTN-SAC 1:1 coamorphous/TMPS (Budiman, Arif, et al. International Journal of Pharmaceutics 600 (2021): 120492).
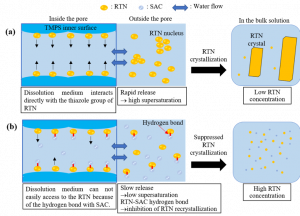
Gambar 6. Schematic illustration of RTN dissolution from (a) RTN amorphous/TMPS and (b) RTN-SAC 1:1 coamorphous/TMPS (Budiman, Arif, et al. International Journal of Pharmaceutics 600 (2021): 120492).
- Studi mekanisme dari obat dalam sistem larutan lewat jenuh/supersaturasi.
Metode-metode yang dikembangkan untuk meningkatkan kelarutan dan penyerapan obat yang sukar larut dalam air, dapat menghasilkan kondisi larutan lewat jenuh atau supersaturasi. Supersaturasi adalah keadaan di mana obat dilarutkan diatas kelarutan kristal obat, dan telah menarik perhatian sebagai teknik untuk meningkatkan penyerapan obat. Penelitian kami juga telah membahas mekanisme dari sistem larutan lewat jenuh/supersaturasi dari obat yang dibuat dalam keadaan amorf dengan dan tanpa penambahan silika mesopori (Gambar 7).
Gambar 7. Data kelarutan dan ilustrasi dari mekanisme obat dalam keadaan amorf dengan dan tanpa silika mesopori pada sistem larutan lewat jenuh/supersaturasi (Budiman, A., & Aulifa, D. L. Pharmaceuticals 15.6 (2022): 730).