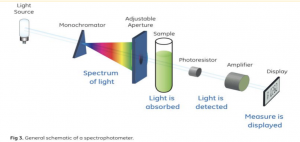
Pertemuan hari ini dilaksanakan di gedung C2 lantai 2, kampus FK Unpad Jatinangor, tepatnya di laboratorium biomedik dasar. Kegiatan yang akan dilakukan hari ini adalah diskusi terkait prinsip kerja dalam penggunaan flow cytometry dan simulasi penggunaan micropipet. Sedikit cerita, hari ini juga merupakan hari pertama OPPEK 2022 atau orientasi fakultas sebagai wahana dalam memperkenalkan lingkungan FK Unpad. Saya menjadi salah satu bagian dari kepanitiaan kegiatan tersebut, sehingga kegiatan hari ini rasanya cukup padat.
Dalam kegiatan hari ini, kelompok kami bergabung bersama kelompok dr. Siska dan dibagi menjadi 2 kelompok secara acak. Kegiatan diawali dengan perkenalan dan pemaparan terkait prinsip kerja flow cytometry, kemudian dilanjutkan dengan diskusi yang dipimpin oleh dr. Ghozali. Selanjutnya, kami diarahkan untuk melakukan sebuah simulasi yang menunjukkan tentang bagaimana cara kerja flow cytometry. Flow cytometry bekerja dengan melakukan penyortiran sel berdasarkan bentuk, ukuran, fungsi dan komponen dalam sel tersebut. Simulasi dilakukan dengan menunjuk salah satu anggota untuk berperan sebagai flow cytometry, dengan anggota lain sebagai sel yang akan disortir. Melalui simulasi ini, saya menjadi lebih paham dan terbayang bagaimana cara flow cytometry bekerja dalam menyortir sel yang dibutuhkan. Pendekatan seperti ini cukup membantu dalam meningkatkan pemahaman, meskipun pada awalnya kami sempat kebingungan.
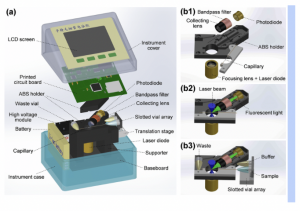
Agenda berikutnya adalah simulasi pipeting. Sebelum melakukan simulasi, kami mendapatkan penjelasan terlebih dahulu mengenai hal-hal yang berkaitan dengan micropipet, seperti bentuk, fungsi, dan cara penggunaannya. Selain penjelasan, kami juga melihat cara penggunaan micropipet yang didemonstrasikan oleh bu Helmi selaku laboran yang bertugas mendampingi kami hari ini.
Berikutnya kami mencoba menggunakan micropipet yang memiliki kapasitas berbeda untuk pengambilan sampel yang terdiri dari ukuran 100-1000 μl, 20-200 μl, dan 2-20 μl.

Karena perbedaan ukuran ini, dibutuhkan pula tip (ujung pipet) yang berbeda ukuran dengan seperti gambar berikut:


Cara pemasangan tip pada mikropipet dilakukan dengan menekan ujung mikropipet ke dalam tip dengan gerakan sedikit memutar. Tempat tip harus selalu ditutup ketika selesai memasangkan tip agar tidak terjadi kontaminasi pada tip yang belum digunakan. Tip yang digunakan untuk berbagai macam sampel harus berbeda untuk menghindari kontaminasi. Tip yang sudah digunakan harus dipisahkan atau dibuang ke dalam wadah khusus. Cara melepas tip dari mikropipet adalah dengan menekan tombol khusus di bagian atas mikropipet.
Cara menggunakan mikropipet diawali dengan mengatur volume yang diinginkan kemudian memegang mikropipet dengan cara seperti ingin meninju dengan ibu jari berada pada bagian pengatur volume seperti gambar berikut:

Untuk mengambil sampel, tekan tombol plunger button (bagian ujung atas mikropipet) dengan ibu jari seperti gambar berikut, lalu angkat jempol supaya sampel dapat masuk ke dalam tip.

Saat memasukan sampel ke tabung sampel, tekan plunger button hingga sampel tidak tersisa. Setelah selesai, lepaskan tip dan masukkan ke dalam wadah khusus.
Setelah melakukan simulasi menggunakan mikropipet, kami merapikan kembali alat-alat yang digunakan. Sebagai penutup kegiatan hari ini, kami melakukan foto bersama dan mengucapkan terima kasih kepada bu Helmi dan staff laboratorium biomedik dasar atas pembelajarannya hari ini. Saat itu, kebetulan dr. Ghozali dan bu Nayla telah berpamitan di tengah kegiatan.
Kegiatan hari ini memberikan kesan baru bagi saya karena dapat hadir dalam 2 kegiatan sekaligus, yaitu mengikuti kegiatan OPPEK sekaligus mengikuti salah satu rangkaian kegiatan elektif.