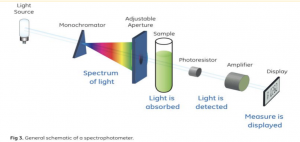
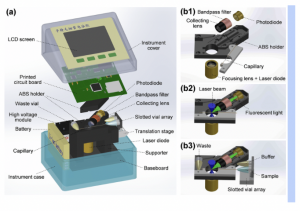
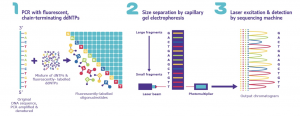
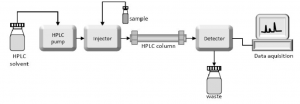
Seminar Pakar 13 Agustus 2022.
Pada hari ini, saya mengikuti seminar pakar pertama yang dibawakan oleh dr. Ghozali. Seminar pakar ini dilaksanakan secara hybrid atau secara offline dan online. Sebenarnya sebelum seminar pakar dilaksanakan, dr. Ghozali mengajak kedua kelompok dr. Ghozali, kelompok dr. Siska dan kelompok bu Nayla untuk melaksanakan jalan pagi mengelilingi Universitas Padjadjaran. Saya tidak mengikuti jalan pagi ini dikarenakan sedang demam dan tidak enak badan sejak kemarin kegiatan luring di gedung Eijkman.
Saya mengikuti seminar pakar secara online bergabung ke zoom meeting pada pukul 8 pagi. Terkait kegiatan seminar pakar offline dilaksanakan pada gedung C3 FK Unpad. Pada seminar pakar hari ini dr. Ghozali memaparkan terkait bagaimana perkembangan kanker payudara di Indonesia khususnya di wilayah Jawa Barat. Beliau juga memaparkan bagimana perkembangan jenis-jenis kanker payudara yang ada di Indonesia. Persentasi seseorang dengan kanker payudara yang ada di seluruh dunia pada tahun 2020 sebanyak 24.5% atau 2.261.419 jiwa yang terkena. Data yang ada di Rumah Sakit Hasan Sadikin (RSHS) sepanjang tahun 2014-2018 diketahui ada sebanyak 913 kasus baru dengan orang kanker payudara yang telah memasuki stadium 3 sebanyak 48% dan stadium 4 sebanyak 16%. Didapati juga sebanyak 254 orang atau 27.8% melakukan tindakan operasi mastektomi atau prosedur operasi untuk mengangkat seluruh jaringan payudara. Setelah pemaparan presentasi dan data yang saya ketahui tersebut saya menanyakan pertanyaan kepada dr. Ghozali terkait penggunaan thermal imaging untuk screening kanker payudara pada stadium awal dengan menggunakan konsep bahwa kanker merupakan pertumbuhan yang tidak terkendali sehingga metabolisme nya sangat tinggi sehingga mungkin menghasilkan panas yang lebih tinggi daripada jaringan normal. Dari pertanyaan tersebut dr. Ghozali menjawab bahwa terdapat perbedaan terkait panas yang di timbulkan metabolisme kanker payudara dengan panas yang ditimbulkan karena metabolisme bakteri pada kulit. Panas yang ditimbulkan dari kanker payudara berasal dari proses inflammasi antara jaringan sehat dan sel kanker sehingga thermal imaging mungkin dapat digunakan untuk mendeteksi kanker payudara pada stadium awal namun membutuhkan banyak pengembangan.
Setelah pertanyaan tersebut, dr.Ghozali sempat membuka sesi tanya jawab sebelum mengakhiri zoom meeting dengan ucapan terima kasih kepada semua peserta seminar pakar online ataupun offline. Pada saat ini juga saya baru saja mendapat kabar bahwa saya terkena COVID-19, dengan bukti pendukung berupa hasil antigen yang reaktif serta gejala berupa demam, batuk dan pilek. Setelah mendapat kabar ini saya pun dijemput oleh kedua orang tua saya kembali ke kampung halaman untuk menjalankan isolasi mandiri.
Pertemuan daring 13 Agustus 2022.
Secara dadakan, dr. Ghozali mengundang kami untuk bergabung pada diskusi daring santai tepatnya pada pukul 7 malam dengan topik “Ngobrol asyik penyakit infeksi”. Sebelumnya dr.Ghozali sudah menerima kabar terkait saya positif COVID-19. Pada sore harinya ketika saya sedan perjalanan ke kampung halaman untuk isolasi mandiri, dr. Ghozali menghubungi saya melalui telepon seluler untuk menanyakan kabar saya, pada saat telfon saya menceritakan gejala saya kepada dr. Ghozali. Saya menceritakan bahwa saya mengalami demam tinggi yang diawali sakit tenggorkan sejak lusa lalu, dilanjut dengan batuk yang progresif dan berpuncak pada 12 Agustus 2022 tepatnya hari jumat dengan demam tinggi. Setelah itu dr. Ghozali mengucapkan hati-hati di jalan dan semoga cepat sembuh serta membaik.
Diskusi daring pada malam ini dimulai dengan dr. Ghozali yang menjelaskan terkait penyakit menular infeksi yaitu COVID-19. Diskusi malam ini dilaksanakan karena adanya kasus COVID-19 yang meningkat serta karena saya sendiri yang merupakan kelompok bu Nayla baru saja positif COVID-19. Kami juga dihimbau untuk tetap hati-hati dalam beraktivitas khususnya anggota kelompok yang mungkin tidak terkena COVID-19 agar tidak tertular. Diskusi berlangsung singkat dan ditutup dengan dr. Ghozali mengucapkan terima kasih dan semangat dalam menjalankan kegiatan elektif.
End.