Flow Cytometry (FACS)
Flow cytometry (FCM) merupakan salah satu metode analisis untuk diagnosis berbagai komponen seluler (asam nukleat, lemak, protein), organel (lisosom, mitokondria), bahkan fungsi (viabilitas, aktivitas enzimatis) dari komponen tersebut. Pada umumnya metode ini
digunakan untuk pengamatan suatu jenis subset sel tertentu yang terdapat pada suatu populasi sel, misalnya diagnosis leukemia dengan mengamati sel-sel limfosit yang terdapat pada populasi PBMC (Peripheral Blood Mononuclear Cell). Selain itu, FCM juga digunakan untuk menghitung secara relatif dan menyortir sel.

Bagian alat dan fungsinya:
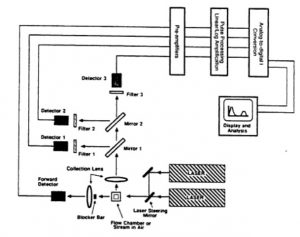
- Sistem Fluida
Sistem fluida mengarahkan sel melalui cahaya (laser) untuk dianalisis, terdiri dari sheath fluid dan central channel. Tenaga hidrodinamik mengakibatkan sel satu per satu melewati central channel. - Sistem Optik
Sistem optik terdiri atas laser sebagai sumber cahaya dan mengeksitasi (fluorochrome) sel dalam aliran sampel, serta filter optik untuk mengarahkan sinyal cahaya yang dihasilkan ke detektor yang sesuai. - Sistem Elektronik
Sistem elektronik berfungsi untuk mendeteksi cahaya dan mengubahnya ke bentuk sinyal digital. Data yang dihasilkan oleh flow cytometer dapat diplot dalam satu dimensi, untuk menghasilkan histogram atau dalam dua dimensi plot titik, atau bahkan dalam tiga dimensi.
Prinsip kerja:
- Flow cytometry menggunakan prinsip menyebarkan cahaya, eksitasi cahaya, dan pemancaran molekul fluorokrom untuk menghasilkan data multi parameter yang spesifik dari partikel dan sel yang memiliki rentang ukuran diameter antara 0,5–40 μm.
- Secara hidrodinamika, sel-sel difokuskan dalam sebuah tabung sebelum melewati dan disinari oleh sumber cahaya.
- Laser merupakan sumber cahaya yang digunakan pada Flow cytometry, dan prinsip kerja yang digunakan memfokuskan hidrodinamika untuk mempresentasikan sel ke sumber cahaya. Pada tahap ini sel akan tersinari oleh laser dan dipresentasikan kembali dalam bentuk suatu diagram tertentu berdasarkan parameter dibawah ini:
- Parameter FSC (Forward Scatter) merupakan parameter yang menunjukkan ukuran dari sel yang teramati. Prinsip pengukuran dari FSC dilakukan dengan mengukur jarak sinar laser yang terhalangi oleh sel yang diterima Forward Detector. Semakin besar jarak tersebut, maka sel itu memiliki ukuran yang relatif lebih besar.
- Parameter SSC (Side Scatter) adalah parameter yang menunjukkan struktur internal atau granularitas dari sel yang teramati. Prinsip pengukuran dari SSC dilakukan dengan mengukur jumlah sinar laser yang terhalangi & dibelokkan oleh struktur internal sel yang diterima detektor. Semakin banyak berkas yang dibelokkan dan diterima Side Detector, maka sel itu memiliki struktur internal yang relatif lebih kompleks.
GeneXpert
Definisi: GeneXpert merupakan pemeriksaan molekuler dengan metode “real time“ PCR dan merupakan penemuan terobosan untuk mendiagnosis TB secara cepat maupun mendeteksi biomarker pada sel-sel kanker.
- Xpert MTB/RIF → menggunakan prinsip reaksi hemi-nested real-time PCR untuk deteksi bakteri MTBC dan kebal obat rifampicin (Resistant Rifampicin = RR)
- Xpert Breast Cancer STRAT4 → memberikan penentuan semi-kuantitatif tingkat mRNA ER/PGR/HER2/Ki-67 (4 biomarker) di bagian kanker payudara invasif
Bagian alat:

Prinsip kerja:
(GeneXpert banyak jenisnya tergantung mau deteksi apa tapi intinya menggunakan metode PCR)
Pemeriksaan TCM dengan GeneXpert, bakteri dalam sputum dilisiskan dan DNA bakteri diisolasi. Fragmen DNA spesifik M.tb diamplifikasi jutaan kali dengan Real Time Polymerase Chain Reaction. Primer dalam assai GeneXpert MTB/RIF memperbanyak bagian dari gen rpoB yang mengandung 81 pasangan basa “core”. Probes dapat membedakan conserved wild-type sequence dan mutasi pada core yang berhubungan dengan resisten terhadap rifampisin.
ELISA
Definisi: ELISA merupakan singkatan dari Enzyme-Linked Immunosorbent Assay. Adalah teknik yang menggabungkan spesifisitas antibodi dengan sensitivitas uji enzim secara sederhana, dengan menggunakan antibodi atau antigen yang digabungkan ke suatu enzim yang mudah diuji. Seringnya digunakan untuk mendeteksi infeksi virus, terutama yang penularannya melalui darah, seperti HBV, HCV, HIV, dan HTLV.
Fungsi :
- Memberikan pengukuran antigen atau antibodi yang baik secara relatif maupun kuantitatif.
- Mendeteksi adanya antigen yang dikenali oleh antibodi atau menguji antibodi yang mengenali antigen.
Komponen:
- ELISA reader
- ELISA kit
- Microplate: Fase padat paling sering memiliki 96-sumur, dan setiap sumur dilapisi secara nonkovalen dengan antigen atau antibodi.
- Sample Diluent: Suatu larutan yang digunakan untuk mengencerkan sampel ke konsentrasi yang tepat untuk uji ELISA.
- Control(s): Biasanya ada kontrol positif dan kontrol negatif. Nilai OD dari kontrol negatif tidak boleh lebih tinggi dari nilai standar, dan nilai OD dari kontrol positif tidak boleh lebih rendah dari nilai standar, atau tes tidak valid.
- Standard(s) or Calibrator(s): Manufaktur akan memberikan standar konsentrat yang diketahui berbeda atau Kalibrator konsentrat yang sama. Dengan menggunakan standar, peneliti bisa mendapatkan kurva, dan membaca nilai konsentrat sampel dari kurva. Dengan menggunakan kalibrator, peneliti bisa mendapatkan nilai cut-off, dan menggunakannya untuk mendapatkan rasio sampel/kalibrator, untuk nilai konsentratnya.
- Conjugate: Ini berisi antibodi sekunder, yang akan mengikat kompleks antibodi-antigen. Dan itu terkait dengan enzim untuk bereaksi dengan substrat.
- Substrate: Substrat bereaksi dengan enzim untuk menghasilkan perubahan warna, yang dimaksudkan untuk mengukur jumlah antibodi atau antigen. TMB (3,3′,5,5′-Tetramethylbenzidine) adalah substrat yang sering digunakan dalam ELISA kit.
- Stop Solution: Menghentikan reaksi, biasanya larutan campuran H2SO4 dan HCI.
- Wash Buffer(s): Ketika pengguna menghapus antibodi atau antigen yang tidak terikat, mereka memilih buffer pencuci konsentrat yang tepat.
Prinsip kerja berdasarkan kombinasi antigen-antibodi, ELISA dibagi menjadi:
- Direct
ELISA jenis ini merupakan ELISA yang paling sederhana. Antigen target diimobilisasi pada permukaan sumur microplate secara langsung. ELISA direct hanya menggunakan satu jenis antibodi deteksi yang terkonjugasi dengan enzim. ELISA direct memiliki beberapa keunggulan yaitu sederhana, cepat, relatif lebih murah, dan mengurangi kemungkinan cross reactivity. Kekurangan ELISA jenis ini yaitu tidak dapat mengamplifikasi sinyal sehingga kurang sensitif.
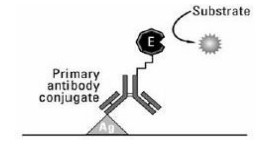
- Indirect
ELISA jenis indirect merupakan hasil pengembangan ELISA direct. Pada ELISA jenis ini sinyal dapat diamplifikasi. Sama seperti ELISA direct, antigen target pada ELISA ini diimobilisasi pada permukaan sumur microplate secara langsung. Namun ELISA indirect menggunakan dua jenis antibodi, yaitu antibodi deteksi yang tidak terkonjugasi dengan enzim (antibodi primer) dan antibodi yang terkonjugasi dengan enzim (antibodi sekunder). Jenis antibodi primer yang biasanya digunakan adalah antibodi monoklonal sedangkan jenis antibodi sekundernya adalah antibodi poliklonal. Kekurangan ELISA jenis ini yaitu adanya kemungkinan cross reactivity antara antibodi primer dan sekunder.
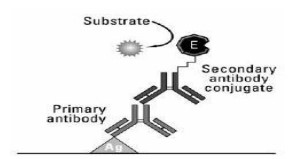
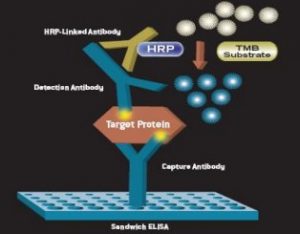
- Sandwich
ELISA sandwich merupakan jenis ELISA yang paling sering digunakan dalam bidang klinis maupun riset. Berbeda dengan dua jenis ELISA sebelumnya, ELISA jenis ini diawali dengan tahap capture. Antigen target diimobilisasi dengan bantuan antibodi lain yang disebut antibodi capture. Oleh karena itu, ELISA sandwich membutuhkan dua antibodi atau lebih. Antibodi yang bertugas untuk membantu proses imobilisasi antigen disebut antibodi capture sedangkan antibodi yang berfungsi untuk mendeteksi kehadiran antigen disebut antibodi deteksi. Kedua antibodi tersebut harus dapat mengenali epitop yang berbeda. ELISA sandwich memiliki keunggulan dibanding dua jenis sebelumnya, yaitu lebih spesifik dan dapat mengamplifikasi sinyal. Kekurangan jenis ini adalah lebih mahal, lebih lama, dan adanya kemungkinan cross reactivity.
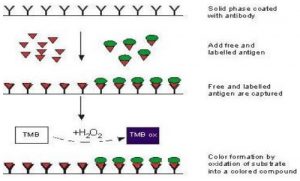
- Competitive
Pada ELISA jenis ini, antigen yang berlabel akan berkompetisi dengan antigen yang tidak berlabel untuk berikatan dengan antibodi primer. Pengukuran sinyal pada ELISA jenis ini berbeda dengan ketiga jenis sebelumnya. Jika pada ketiga jenis lain semakin banyak antigen dalam sampel maka sinyalnya akan semakin kuat. Namun, pada ELISA ini semakin banyak antigen dalam sampel, semakin sedikit antigen berlabel yang terikat pada sumur dan sinyalnya akan semakin lemah.
 Sumber: 1, 2, 3
Sumber: 1, 2, 3
MiSeq
Definisi: Sistem MiSeq menggabungkan teknologi Sequencing by Synthesis (SBS) dengan alur kerja revolusioner, dari DNA hingga data yang dianalisis hanya dalam waktu delapan jam. MiSeq mengintegrasikan cluster generation, sequencing, dan analisis data pada satu instrumen.
Komponen:
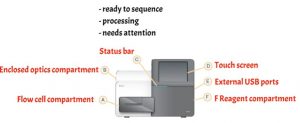
- Flow cell compartment
- Enclosed optics compartment : berisi komponen optik yang memungkinkan flow cell imaging
- Status bar : green (ready), blue (processing), orange (needs attention)
- Touch screen : menampilkan antarmuka perangkat lunak kontrol untuk konfigurasi sistem dan menjalankan pengaturan
- External USB ports
- F Reagent compartment : berisi daerah pada suhu yang tepat, larutan pencuci dan botol untuk daerah bekas
Proses:
Sample prep (Genomic library and adapters)
- Setelah DNA dimurnikan, genomic/DNA library, perlu dibuat.
Ada dua cara perpustakaan genom dapat dibuat, sonifikasi dan tagmentasi. Dengan tagmentasi, transposase secara acak memotong DNA dan menambahkan adaptor secara bersamaan. Sonifikasi memecah DNA menjadi ukuran yang sama menggunakan gelombang suara ultrasonik. - Adaptor terdiri dari 3 segmen : complementary sequence to oligos in flow cell, indeks, dan binding site untuk sequencing primer.
Indeks adalah barcode sequencing untuk mengidentifikasi sampel, yang akan digunakan oleh komputer untuk mengkategorisasikan setiap sampel saat analisis data. Indeks ini yang membuat MiSeq dapat mengoperasikan lebih dari 96 sampel sekaligus.
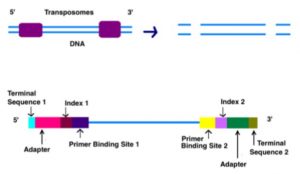
- Flow cell memiliki oligonukleotida (urutan nukleotida pendek) yang melapisi bagian bawah sel, dan mereka berfungsi sebagai pendukung padat untuk menahan untaian DNA di tempatnya selama pengurutan. Saat DNA yang terfragmentasi dicuci di atas sel aliran, adaptor yang sesuai menempel pada pendukung padat komplementer.

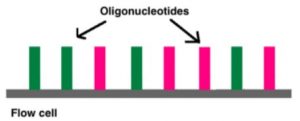
Cluster generation by bridge amplification
Setelah terpasang, pembuatan cluster dapat dimulai.
Tujuannya adalah untuk membuat ratusan untaian DNA yang identik. Beberapa akan menjadi untaian depan; sisanya, sebaliknya. Inilah sebabnya mengapa adaptor kanan dan kiri digunakan. Proses ini disebut bridge amplification, dan itu terjadi pada ribuan kelompok di seluruh sel aliran sekaligus.
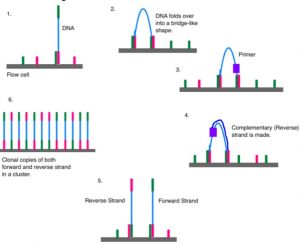
Sequencing (SBS)
Pada akhir amplifikasi klon, semua untaian terbalik dicuci dari sel aliran, hanya menyisakan untaian maju. Tiga ujung utama diblokir untuk mencegah priming yang tidak diinginkan.
- First read :
Sekuensing dimulai dengan perpanjangan primer sekuensing pertama untuk menghasilkan pembacaan pertama. Dengan setiap siklus, nukleotida yang ditandai dengan fluoresensi bersaing untuk menambah rantai yang sedang tumbuh.
Setelah penambahan setiap nukleotida, kluster dieksitasi oleh sumber cahaya dan sinyal fluoresen yang khas dipancarkan. Proses kepemilikan ini disebut Sequencing-by-Synthesis.
Jumlah siklus menentukan panjang pembacaan. Panjang gelombang emisi, bersama dengan intensitas sinyal, menentukan panggilan dasar. - Index 1 read :
Setelah selesai membaca pertama, produk yang telah dibaca tersapu bersih. Pada langkah ini primer baca indeks 1 diperkenalkan dan dihibridisasi ke template. Bacaan dihasilkan, mirip dengan pembacaan pertama. - Index 2 read :
Setelah pembacaan indeks selesai, produk yang telah dibaca dicuci, dan ketiga ujung utama template dideprotect. Template sekarang melipat dan mengikat oligo kedua pada sel aliran. Indeks 2 dibaca dengan cara yang sama seperti indeks 1. Polimerase memperpanjang oligo sel aliran kedua membentuk jembatan untai ganda. - Reverse strand read :
DNA untai ganda ini kemudian dilinearisasi dan ketiga ujung prima diblokir. Untai depan asli dibelah dan hanyut hanya menyisakan untai sebaliknya.Read 2 dimulai dengan pengenalan primer sequencing read 2.Seperti membaca 1, langkah-langkah pengurutan diulang sampai panjang baca yang diinginkan tercapai. Produk read 2 kemudian dicuci.
Data analysis oleh komputer
PCR
Definisi: Polymerase Chain Reaction (PCR) adalah suatu teknik yang digunakan untuk membuat banyak salinan dari suatu segmen DNA, proses ini akan menghasilkan sejumlah besar salinan dari sampel awal yang kecil
Bagian alat dan fungsinya: PCR berguna dalam membuat salinan DNA yang memungkinkan sejumlah kecil sekuens DNA disalin berkali-kali untuk diperbanyak sehingga dapat dianalisa atau dimodifikasi secara tertentu. Contohnya, PCR dapat digunakan untuk menambahkan situs enzim restriksi, atau untuk memutasikan (mengubah) basa tertentu pada DNA, dan dapat digunakan untuk mendeteksi keberadaan sekuens DNA tertentu dalam sampel
Prinsip kerja: Prinsip kerja PCR mencontoh bagaimana DNA di dalam tubuh diperbanyak (replikasi DNA). Seperti dalam proses replikasi DNA pada organisme hidup, teknik PCR juga membutuhkan sebuah Enzim DNA polymerase yang bertugas untuk membuat kopian strand DNA baru dengan menggunakan strand DNA yang sudah ada sebagai template. DNA polimerase yang biasanya digunakan pada teknik proses PCR disebut dengan Taq polymerase, yaitu enzim DNA polimerase stabil yang berhasil diisolasi dari bakteri termofilik ekstrem Thermus aquaticus yang hidup pada dinding geyser vulkanik. Sifatnya yang thermostabil membuat Taq polymerase ideal untuk digunakan pada tahap pemisahan (denaturasi) template DNA.
Selain Taq polymerase, adanya Primer juga dibutuhkan, sekuen nukleotida pendek yang dapat menginisiasi starting point dari sintesis DNA. Dalam reaksi berantai (Polymerase Chain Reaction) PCR, pelaku eksperimen sudah menentukan sebelumnya daerah DNA mana yang akan dikopi dan diamplifikasi dengan memilih urutan primer mana yang akan digunakan. Primer PCR berupa single stranded DNA dan panjangnya berukuran sekitar 20 nukleotida. Pada prinsip kerja PCR, digunakan sebanyak 2 primer yang didesain mengapit daerah DNA yang ingin diperbanyak.
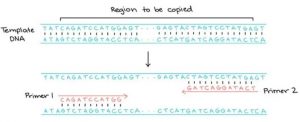 Setelah primer berikatan dengan DNA template, untai tunggal DNA akan diperpanjang oleh enzim DNA polimerase dan daerah yang diapit akan tercopy.
Setelah primer berikatan dengan DNA template, untai tunggal DNA akan diperpanjang oleh enzim DNA polimerase dan daerah yang diapit akan tercopy.
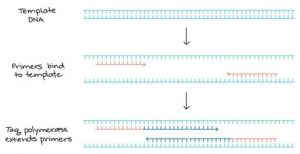
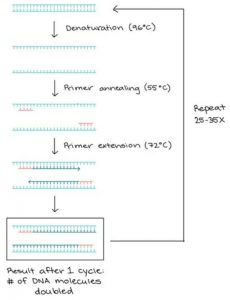
Cara kerja PCR:
Kunci dalam pelaksanaan reaksi PCR membutuhkan Taq Polymerase, Primer, DNA templat dan nukleotida (blok pembangun DNA). Keseluruhan bahan digabung dalam sebuah tube, bersama kofaktor yang dibutuhkan oleh enzim, dan melewati siklus pemanasan dan pendinginan berulang yang memungkinkan terjadinya amplifikasi DNA.
Langkah kerja PCR melewati 3 tahap berikut:
- Denaturation/denaturasi (96°C): Pada proses denaturasi, panas mempengaruhi strand DNA akan terpisah menjadi DNA beruntai tunggal (single-stranded).
- Annealing/penempelan (55-65°C): Pada tahap penempelan ini, suhu annealing primer akan menempel dan berikatan pada daerah komplementer pada sekuen single-stranded DNA.
- Extension/elongasi (72°C): Pada suhu ini Taq polymerase melakukan pemanjangan membentuk strand DNA baru.
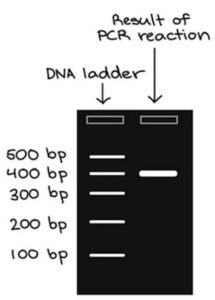
Hasil dari reaksi PCR dapat divisualisasi menggunakan Gel Electrophoresis. Prinsip dari gel electrophoresis yaitu pemanfaatan kutub positif dan negatif elektroda untuk menarik fragmen DNA di dalam matriks gel berarus listrik sehingga fragmen DNA terpisah berdasarkan ukurannya. Sebagai standar digunakan DNA ladder untuk mengukur ukuran suatu fragmen DNA hasil PCR. Fragmen DNA dengan panjang yang sama membentuk ‘pita’ pada gel, yang dapat dilihat dengan mata jika gel diwarnai dengan pewarna pengikat DNA. Sebagai contoh, reaksi PCR yang menghasilkan fragmen 400 Base Pair (bp) terlihat seperti pada gel.
Elektroforesis
Elektroforesis → Elektro (medan listrik) + Phoresis (migrasi)
Elektroforesis adalah metode pemisahan dimana molekul bermuatan bermigrasi dalam kecepatan diferensial di medan listrik yang diterapkan. Molekul bermuatan bermigrasi ke arah elektroda bermuatan berlawanan di bawah pengaruh medan listrik:
- Molekul yang bermuatan negatif (-) bergerak ke anode (+)
- Molekul yang bermuatan positif (+) bergerak ke anode (-)
DNA mempunyai muatan negatif dan mempunyai rasio muatan/massa yang konstan, sehingga kecepatan migrasi DNA selama elektroforesis tergantung pada berat molekul DNA tersebut.
Untuk pemisahan DNA berukuran kecil (< 200 pasang basa) digunakan gel poliakrilamida sedangkan untuk pemisahan DNA berukuran besar digunakan gel agarosa. DNA dalam gel agarosa dapat terlihat dengan penambahan red gel yang akan berikatan dengan DNA dan akan bersifat fluorescens dibawah sinar UV. Penambahan loading dye dilakukan bertujuan sebagai penanda pergerakan DNA dalam gel agarose.
Jenis-jenis Elektroforesis:
- Elektroforesis kertas adalah jenis elektroforesis yang terdiri dari kertas sebagai fase diam dan partikel bermuatan yang terlarut sebagai fase gerak, terutama ialah ion-ion kompleks. Pemisahan ini terjadi akibat adanya gradasi konsentrasi sepanjang sistem pemisahan. Pergerakan partikel dalam kertas tergantung pada muatan atau valensi zat terlarut, luas penampang, tegangan yang digunakan, konsentrasi elektrolit, kekuatan ion, pH, viskositas, dan absorptivitas zat terlarut.
- Elektroforesis gel adalah elektroforesis yang menggunakan gel sebagai fase diam untuk memisahkan molekul-molekul. Awalnya elektroforesis gel dilakukan dengan medium gel kanji (sebagai fase diam) untuk memisahkan biomolekul yang lebih besar seperti protein-protein. Kemudian elektroforesis gel berkembang dengan menjadikan agarosa dan poliakrilamida sebagai gel media. Perpindahan partikel pada medium gel dipengaruhi oleh faktor-faktor seperti ukuran partikel, komposisi dan konsentrasi gel, densitas muatan, kuat medan listrik dan sebagainya. Semakin kecil partikel → pergerakan atau migrasinya akan semakin cepat karena matriks gel mengandung jaringan kompleks berupa pori-pori sehingga partikel-partikel tersebut dapat bergerak melalui matriks tersebut.
- Elektroforesis kapiler adalah metode elektroforesis canggih. Ini dikembangkan dengan maksud untuk meminimalkan waktu yang dibutuhkan untuk pemisahan dan analisis dalam elektroforesis lempengan. Elektroforesis kapiler ini membutuhkan sampel kecil dalam kisaran jika 0,1 hingga 10 μl sedangkan metode lempeng membutuhkan dalam μl. Juga, metode ini menghasilkan pemisahan dengan kecepatan tinggi dan resolusi tinggi. Selain itu, komponen yang terpisah yang keluar dari salah satu ujung kapiler, segera dianalisis oleh detektor yang dipasang di ujung tabung.
Kegunaan Elektroforesis:
- Untuk memisahkan molekul kompleks: Banyak molekul biologis kompleks seperti vitamin B12, Antibiotik, protein dapat dipisahkan secara efisien dengan elektroforesis. Ini dimungkinkan karena perbedaan muatan di antara campuran.
- Untuk analisis molekul asam nukleat seperti studi RNA dan DNA. Molekul rantai panjang ini dapat dianalisis hanya setelah pemisahan setelah elektroforesis. Ini membantu menentukan ukuran atau kerusakan pada molekul DNA atau RNA.
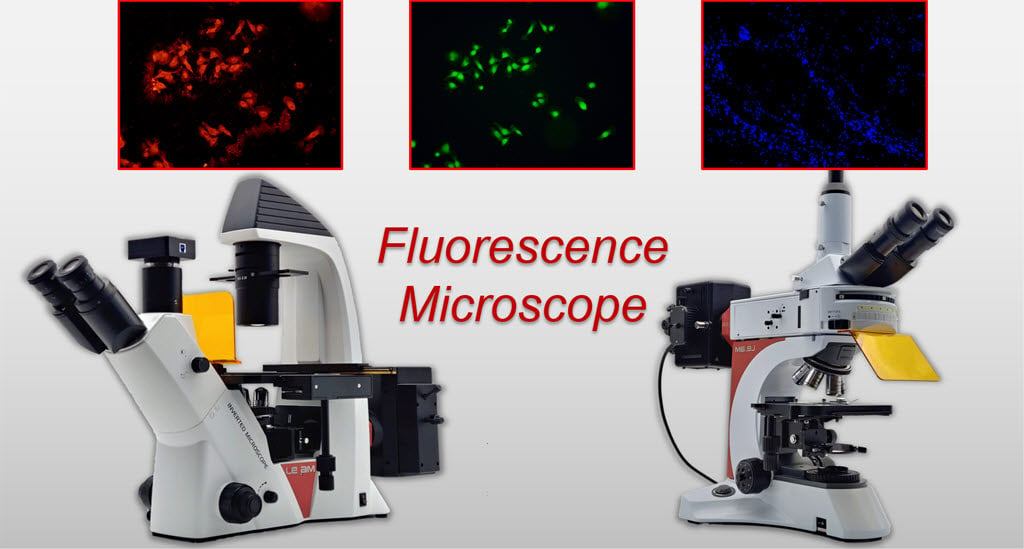
Fluorescence Microscope
Fluorescence microscope adalah salah satu mikroskop cahaya yang menggunakan fenomena fluoresensi untuk mengamati suatu objek, biasanya sampel biologis hidup (struktur sel, mikroorganisme, antibodi).
Fluoresensi sendiri merupakan fenomena di mana suatu molekul bisa menyerap energi dari radiasi gelombang elektromagnetik yang pendek (energinya tinggi dan tidak nampak) untuk kemudian mengeluarkan gelombang yang lebih panjang (energinya lebih rendah dan nampak).
Beberapa sel/mikroorganisme biasanya sudah memiliki substansi fluoresen sehingga bisa terlihat bersinar di bawah sinar UV. Walaupun begitu sampel-sampel yang tidak memiliki substansi fluoresen sekalipun masih bisa diamati dengan mikroskop ini dengan cara diwarnai terlebih dahulu dengan pewarna fluoresen, fluorochromes (fluorescent dyes).
Bagian alat dan fungsinya:
Bagian inti dari mikroskop fluoresensi, meliputi:
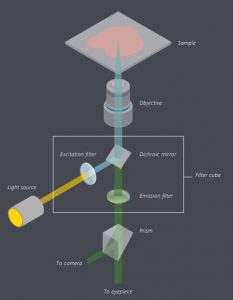
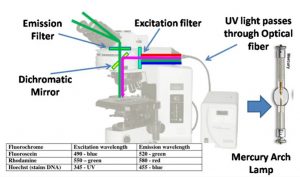
- Fluorofor (Substansi Fluoresen)
Senyawa kimia yang memiliki kemampuan untuk memancarkan cahaya karena tereksitasi oleh gelombang elektromagnetik atau cahaya. Biasanya dijadikan untuk jadi zat pewarna pada sampel. - Sumber Cahaya
Sumber gelombang elektromagnetik yang nantinya akan dikirimkan ke sampel untuk bisa menstimulasi sampel, khususnya fluorochrome yang ada di sampel mengeluarkan gelombang elektromagnetik yang lebih panjang (cahaya tampak). Sumber cahaya yang digunakan biasanya xenon arc lamps or mercury-vapor lamps (cahaya UV), lasers, and high- power LEDs - Filter Eksitasi
Filter bandpass yang hanya bisa meloloskan cahaya dengan gelombang yang bisa diserap oleh fluorofor, sedangkan radiasi cahaya yang dipantulkan terhalang. - Cermin Dichroic
Filter warna yang akurat berbentuk film tipis yang secara selektif meloloskan cahaya dengan intensitas yang rendah (gelombang yang lebih panjang) dan memantulkan yang lainnya. - Filter Emisi
Filter bandpass yang hanya bisa meloloskan cahaya dengan gelombang yang diemisikan oleh fluorofor, sedangkan radiasi cahaya yang lainnya terhalang.
Prinsip kerja:
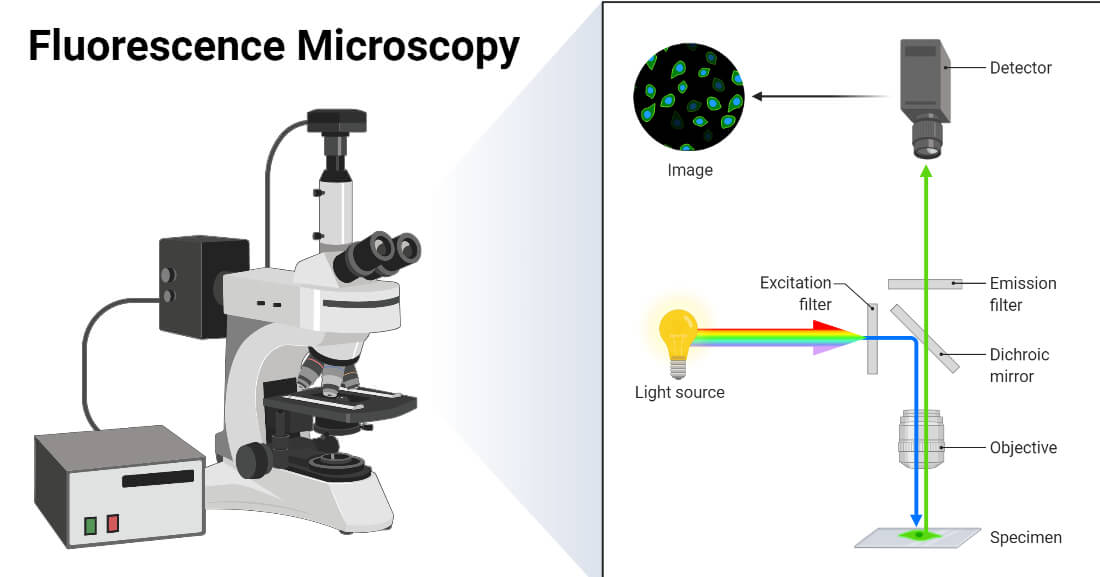
Dimulai dari gelombang cahaya dengan intensitas yang tinggi dan panjang gelombang pendek (UV, LED, Laser) yang dipancarkan oleh sumber cahaya. Cahaya ini akan difilter oleh filter eksitasi yang sudah diatur sehingga panjang gelombang yang bisa lolos hanya yang sesuai untuk bisa diserap oleh fluorofor. Setelah difilter cahaya akan dipantulkan oleh cermin dichroic dan difokuskan oleh lensa objektif untuk mengenai sampel. Setelah zat fluorofor pada sampel menyerap cahaya, zat fluorofor mengemisikan cahaya dengan gelombang yang lebih panjang dan intensitas yang lebih tinggi. Lalu, cahaya ini diteruskan oleh lensa objektif dan cermin dichroic, sehingga sampai di detector dan bisa diamati.
HPLC
Definisi:
- High = tinggi
- Pressure = tekanan
- Liquid = cairan
- Chromatography = suatu metode pemisahan molekul yang melibatkan fase diam dan fase gerak
HPLC = metode pemisahan molekul dengan media cair yang diberikan tekanan tinggi.
Kromatografi merupakan sebuah teknik atau metode pemisahan molekul yang didasarkan pada perbedaan pola pergerakan antara fase gerak dan fase diam. Kromatografi digunakan untuk memisahkan komponen (berupa molekul) yang berada pada suatu larutan.
HPLC adalah alat laboratorium yang bekerja dengan metode fisikokimia, didasarkan pada teknik kromatografi dimana fase geraknya berupa cairan dan fase diamnya bisa berupa memiliki bentuk padat atau cair.
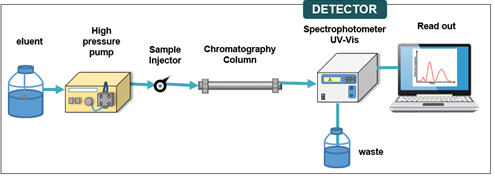
Bagian alat:

- Pompa = memberikan tekanan untuk proses pemisahan
- HPLC column = tempat proses pemisahan
- Terdapat fase diam (padatan) → maka dari itu membutuhkan tekanan untuk membuat fase diam (cairan) melewati fase diam (padatan) pada bagian ini
- Ukurannya berbeda-beda
- Panjang = pemisahan optimal, waktu lebih lambat
- Pendek = pemisahan kurang optimal, waktu cepat
- Solvent Organizer = untuk menghilangkan pengaruh gelembung (gas) atau mengurangi fluktuasi tekanan yang menyebabkan baseline conditioning tidak bisa tercapai. Harus sama pada setiap bagian, kecuali sample injector
- High Pressure Pump = pompa memiliki tekanan (6000-9000 psi)
- Besar tekanan pompa → waktu lebih singkat & penggunaan solvent berkurang
- Auto Sampler = injeksi sampel menggunakan alat
- Column Oven = untuk menjaga suhu atau temperatur pada range tertentu, hal ini dilakukan karena pengukuran nilai pada mobile phase bisa berubah pada suhu yang berbeda → hasil lebih akurat
Fungsi HPLC:
Penggunaan alat HPLC sangat erat kaitannya dengan dunia industri obat dan makanan. Fungsi HPLC adalah untuk menentukan atau mengukur atau menganalisa kadar bahan aktif pada suatu sample (obat, makanan atau herbal). Pada beberapa kasus yang berhubungan dengan obat herbal, alat ini digunakan untuk menentukan marker pada suatu obat herbal.
Prinsip kerja:
- HPLC memisahkan molekul berdasarkan perbedaan afinitasnya terhadap zat padat tertentu (setiap senyawa mempunyai afinitas selektif antara fase diam tertentu dan fase gerak tertentu)
- Fase Gerak masuk (solvent dan sampel) → dipompa menggunakan pump untuk memberikan tekanan → fase gerak dapat mengalir → masuk ke dalam column → terjadi proses pemisahan → hasil dideteksi → keluar dalam bentuk kromatogram
- Jenis komponen fase gerak dan fase diam akan menentukan hasil (sesama polar akan lebih mudah terikat)
Cara pengoperasian alat:

- Perhatikan pipa atau selang outlet sudah terletak pada penampung yang benar. karena ini penting untuk menampung limbah proses analisa.
- Fokus ke software yang ada di komputer. Sebelum dan setelah menggunakan alat laboratorium ini diharapkan melakukan flush atau purge atau dikenal dengan istilah pencucian kolom. Hal ini dilakukan agar kondisi kolom selalu dalam keadaan bersih dan tidak tersumbat. Pastikan membuka katup tekanan sebelum melakukan pembersihan kolom.
- Perhatikan dan pastikan larutan yang digunakan untuk fase gerak tersedia dalam jumlah yang cukup. Beberapa jenis larutan yang digunakan diantaranya adalah : Asetonitril, Metanol atau Aquabidest.
- Lakukan setting method pada software HPLC. Pada tahap ini diminta untuk melakukan setting detail mengenai aplikasi, komposisi dan waktu injeksi. Jika sebelumnya sudah memiliki method, tidak perlu membuat baru, gunakan saja yang sudah ada.
- Operasikan instrumen untuk mendapatkan base line yang stabil. Jika belum mendapatkan base line yang stabil, perhatikan langkah-langkah sebelumnya. Jika masih pemula, mintalah seseorang yang lebih ahli untuk membantu dalam hal ini.
- Pastikan tidak terdapat gelembung pada cairan fase gerak. Salah satu hal yang membuat base line menjadi tidak stabil adalah adanya gelembung. Beberapa jenis HPLC biasanya dilengkapi dengan degasser.
- Setelah base line didapat bisa mulai memasukan sample. Dengan cara injeksi manual atau auto sampler, itu tergantung konfigurasi dari alat. Kelebihan menggunakan auto sampler tentunya lebih otomatis dan presisi.
- Detektor akan menangkap data dari sampel dan menampilkannya di software. Pada beberapa kasus mungkin saja anda menemukan puncak ganda, dan belum langsung menemukan puncak tunggal pada chromatogram. Lakukan optimasi jika diperlukan.
- Save atau print hasil pengukuran.
Sanger Sequencing
Sanger sequencing, juga dikenal sebagai “metode pemutusan rantai”, adalah metode untuk menentukan urutan nukleotida DNA. Metode ini dikembangkan oleh dua kali Peraih Nobel Frederick Sanger dan rekan-rekannya pada tahun 1977, oleh karena itu dinamakan Sanger Sequence.
Gambar alat:
Nama alat: genetic analyzer

Prinsip kerja:

Urutan DNA untuk PCR terminasi rantai
Urutan DNA yang diinginkan digunakan sebagai cetakan untuk jenis PCR khusus yang disebut PCR pemutusan rantai. PCR pemutusan rantai bekerja seperti PCR standar, tetapi dengan satu perbedaan utama: penambahan nukleotida termodifikasi (dNTPs) yang disebut dideoksiribonukleotida (ddNTPs). Pada langkah ekstensi PCR standar, DNA polimerase menambahkan dNTPs ke untai DNA.
- Dalam pengurutan Sanger manual, empat reaksi PCR diatur, masing-masing hanya dengan satu jenis ddNTP (ddATP, ddTTP, ddGTP, dan ddCTP) yang dicampur.
- Dalam pengurutan Sanger otomatis, semua ddNTP dicampur dalam satu reaksi, dan masing-masing dari empat dNTP memiliki label fluoresen yang unik.
Pemisahan ukuran oleh gel elektroforesis
Pada langkah kedua, oligonukleotida yang diakhiri rantai dipisahkan berdasarkan ukuran melalui elektroforesis gel. Dalam elektroforesis gel, sampel DNA dimasukkan ke salah satu ujung matriks gel, dan arus listrik diterapkan; DNA bermuatan negatif, sehingga oligonukleotida akan tertarik menuju elektroda positif pada sisi gel yang berlawanan. Karena semua fragmen DNA memiliki muatan yang sama per satuan massa, kecepatan pergerakan oligonukleotida hanya akan ditentukan oleh ukuran. Semakin kecil sebuah fragmen, semakin sedikit gesekan yang akan dialaminya saat bergerak melalui gel, dan semakin cepat ia akan bergerak. Akibatnya, oligonukleotida akan disusun dari yang terkecil hingga terbesar, membaca gel dari bawah ke atas.
- Dalam sekuensing Sanger manual, oligonukleotida dari masing-masing dari empat reaksi PCR dijalankan di empat jalur gel yang terpisah. Ini memungkinkan pengguna untuk mengetahui oligonukleotida mana yang sesuai dengan setiap ddNTP.
- Dalam sekuensing Sanger otomatis, semua oligonukleotida dijalankan dalam elektroforesis gel kapiler tunggal di dalam mesin sekuensing.
Analisis gel dan penentuan urutan DNA
Langkah terakhir hanya melibatkan membaca gel untuk menentukan urutan DNA input. Karena DNA polimerase hanya mensintesis DNA dalam arah 5′ ke 3′ mulai dari primer yang disediakan, setiap ddNTP terminal akan sesuai dengan nukleotida spesifik dalam urutan aslinya (misalnya, fragmen terpendek harus berakhir pada nukleotida pertama dari ujung 5′ , fragmen terpendek kedua harus berakhir pada nukleotida kedua dari ujung 5′, dll). Oleh karena itu, dengan membaca pita gel dari yang terkecil hingga terbesar, kita dapat menentukan urutan 5′ hingga 3′ dari untai DNA asli.
- Dalam pengurutan Sanger manual, pengguna membaca keempat jalur gel sekaligus, bergerak dari bawah ke atas, menggunakan jalur untuk menentukan identitas terminal ddNTP untuk setiap band. Misalnya, jika pita bawah ditemukan di kolom yang sesuai dengan ddGTP, maka fragmen PCR terkecil berakhir dengan ddGTP, dan nukleotida pertama dari ujung 5’ dari urutan asli memiliki basa guanin (G).
- Dalam pengurutan Sanger otomatis, komputer membaca setiap pita gel kapiler, dengan menggunakan fluoresensi untuk memanggil identitas setiap terminal ddNTP. Singkatnya, laser menggairahkan tag fluoresen di setiap pita, dan komputer mendeteksi cahaya yang dihasilkan yang dipancarkan. Karena masing-masing dari empat ddNTP ditandai dengan label fluoresen yang berbeda, cahaya yang dipancarkan dapat langsung dikaitkan dengan identitas terminal ddNTP. Keluarannya disebut kromatogram, yang menunjukkan puncak fluoresen setiap nukleotida di sepanjang DNA cetakan.
Hb Test
Hb test: mengukur kadar hemoglobin dalam darah, bisa dilakukan di hematology analyzer atau alat khususnya sendiri.
Hematology Analyzer

Definisi: Hematology analyzer adalah alat laboratorium yang digunakan untuk mengukur dan menghitung jumlah sel darah. Alat yang satu ini mampu melakukan pemeriksaan menggunakan sampel darah untuk mendiagnosa beberapa penyakit. Pemeriksaan hematologi meliputi pemeriksaan hematologi, seperti pemeriksaan kadar hemoglobin, leukosit hingga trombosit.
Prinsip kerja:
Secara umum, prinsip kerja hematology analyzer ini terbilang mudah. Yakni sampel darah yang ada dilakukan pencampuran dengan menggunakan campuran reagen untuk hingga terjadi proses yang disebut dengan hemolyzing. Dari proses ini akan terbagi menjadi beberapa tujuan, bisa pengukuran leukosit, trombosit maupun eritrosit.
Jika sudah, maka semua data dari sampel darah tersebut akan diolah pada mikroprosesor, dan data akan ditampilkan dalam layar monitor.
Jenis-jenis:
- Semi Otomatis: pada jenis ini, proses dilusi atau pencampuran sampel darah dengan koagulan harus dilakukan secara manual. Jadi, tentu saja akan memakan waktu yang lebih lama. Namun, beberapa instansi baik di lembaga penelitian, rumah sakit ataupun klinik masih ada yang menggunakan hematology analyzer semi otomatis untuk digunakan di instansi nya tersebut
- Otomatis: jenis otomatis memiliki banyak kelebihan. Yakni pada proses pemeriksaannya, proses dilusi, hemolyzing (pencampuran sampel dengan reagen pada alat), perhitungan, display dan print out akan dilakukan secara otomatis. Sehingga, proses pun akan berjalan cepat dan efisien.